Комбинированная терапия: современный подход к ведению пациентов с неконтролируемой бронхиальной астмой.
Л. М. Огородова, доктор медицинских наук, профессор,
О. С. Кобякова, Ф. И. Петровский, Ю. А. Петровская
СГМУ, Томск
Бронхиальная астма (БА) относится к числу наиболее распространенных хронических заболеваний. По далеко не полным сведениям, в России бронхиальной астмой страдают около 7 млн. человек, и число больных постоянно увеличивается [2].
Безусловно, эти цифры не внушают оптимизма — такой рост заболеваемости БА нельзя объяснить лишь улучшением качества диагностики и соответственно большей выявляемостью. Более того, показатели смертности вследствие БА из года в год остаются относительно стабильными, несмотря на значительные достижения в терапии данного заболевания, что остается основной проблемой для специалистов.
На рубеже веков встала еще одна немаловажная задача — адекватная оценка контроля над симптомами болезни у пациентов, получающих базисную терапию. По результатам анализа эффективности терапии БА в США и Европе (программы AIRE и AIА), приблизительно у 70% астматиков симптомы болезни по тем или иным причинам должным образом не контролируются [16]. В целом такая ситуация сложилась из-за того, что врачи склонны недооценивать тяжесть течения БА у своих больных, а пациенты — переоценивать результаты лечения. С появлением в 1999 году критериев «хорошо контролируемой» БА, предложенных Bateman E., открылись новые перспективы для разработки терапевтических стратегий ведения пациентов с точки зрения достижения оптимального контроля над течением БА [9].
Терминология
Термин «неконтролируемая БА» подразумевает отсутствие контроля над симптомами болезни по любым причинам. До недавнего времени специалисты были ориентированы на критерии оптимального контроля над БА, изложенные в документе GINA [17]. Установление определенной степени контроля давало право перейти на следующую ступень с соответствующим ей объемом терапии. Однако указанные критерии были сформулированы весьма расплывчато и трактовались неоднозначно.
В 1999 году Bateman E., член руководящего комитета программы Gaining Optimal Asthma Control (GOAL), впервые предложил количественные характеристики «хорошо контролируемой» астмы (Global asthma control: well controlled asthma):
* минимальное число дневных эпизодов бронхообструкции (средняя оценка по шкале симптомов < 1);
* полное отсутствие ночных симптомов (средняя оценка по шкале ночных симптомов < 0,05);
* потребность в b2-агонистах короткого действия не более одной ингаляции в сутки;
* отсутствие обострений;
* суточная лабильность бронхов < 20%;
* среднесуточные значения ПСВ > 80%;
* отсутствие побочных эффектов от проводимой терапии.
* Более того, в настоящее время выделяют три уровня контроля симптомов БА (представленная характеристика соответствует второму (среднему) уровню контролируемости) [10]. Такая модификация критериев отражает различные этапы в достижении контроля над заболеванием.
Клиническая характеристика больных с неконтролируемой БА
Главной клинической, социальной и этической проблемой неконтролируемого течения БА является высокая смертность среди этой категории пациентов. Кроме того, отсутствие контроля над воспалением неуклонно ведет к прогрессированию болезни, что становится основной предпосылкой для увеличения числа тяжелых форм БА, инвалидизации и перехода к следующей необратимой стадии процесса — хронической обструктивной болезни легких (ХОБЛ). На второй план выходят социально-экономические аспекты (высокая стоимость лечения неконтролируемой БА, снижение трудоспособности, трудозатраты врача). Еще один немаловажный момент — разочарование пациента в возможностях современной медицины.
Объективности ради следует признать, что наши знания относительно механизмов возникновения неконтролируемой БА далеко не полные и в ряде случаев противоречивы. В результате пациенты с неконтролируемой БА могут значительно отличаться между собой в том, что касается клинико-функциональных характеристик и особенностей течения заболевания. Из этого следует, что неконтролируемая БА — понятие неоднородное, включающее в себя ряд клинически гетерогенных синдромов, единственным объединяющим признаком которых служит отсутствие контроля над симптомами болезни. У подавляющего большинства пациентов отсутствие контроля обусловлено неадекватной терапией БА. Однако некоторые разновидности неконтролируемой БА имеют специальные наименования вследствие особенностей механизмов их формирования. Так, в настоящее время существует понятие «сложная или терапевтически-резистентная БА», которая может быть определена как неконтролируемая БА, не отвечающая на оптимальную терапию. В свою очередь, выделяют несколько разновидностей сложной астмы, обладающих значительной клинической гетерогенностью [15].
* Фатальная БА - фатальные или близкие к фатальным обострения БА, требующие реанимационных мероприятий из-за развития гиперкапнии, респираторного ацидоза или пневмоторакса.
* Хрупкая БА (или нестабильная, в англоязычной литературе - brittle asthma). Выделяют два варианта хрупкой астмы:
- БА, характеризующаяся значительной вариабельностью ПСВ (>40% в течение дня на протяжении не менее 50% времени за 6-месячный период) на фоне применения высоких доз ингаляционных кортикостероидов (ИКС) (1500 мкг в сутки по беклометазону);
- интермиттирующая тяжелая БА - внезапные острые приступы, развившиеся в течение менее трех часов без объективной причины и на фоне практически нормальной функции легких или хорошо контролируемой БА.
* Хроническая сложная БА - постоянная бронхообструкция, значительно влияющая на качество жизни больного и требующая системной терапии кортикостероидами (КС) с неполным эффектом. Острые тяжелые обострения наблюдаются относительно редко.
Кроме того, отдельно выделяют гормонозависимую, гормонорезистентную формы неконтролируемой БА и ряд других [8].
На примере пациентов с хрупкой (brittle) интермиттирующей астмой можно наглядно продемонстрировать, что под понятие неконтролируемой БА подпадают случаи бронхиальной астмы любой степени тяжести [4]. Данный фенотипический вариант БА по классификации, предложенной в проекте GINA, относится к легкой персистирующей, а в ряде случаев и интермиттирующей астме. Однако для хрупкой астмы характерно развитие внезапных тяжелых, в ряде случаев фатальных обострений БА, что заставило специалистов отнести ее к категории неконтролируемой БА. Хотя, безусловно, у большинства пациентов с неконтролируемой БА заболевание носит тяжелый характер [15].
Структура причин отсутствия контроля над симптомами БА
Диагноз «неконтролируемая БА» в каждом конкретном случае требует тщательного уточнения причин возникшего состояния.
Прежде всего следует убедиться в правильности диагноза «бронхиальная астма» во всех случаях резистентности к антиастматической терапии и нетипичного течения данного заболевания. Часто бывает трудно разграничить БА с ХОБЛ, поскольку в ряде случаев тяжелая БА и ХОБЛ являются стадиями одного процесса и дифференцировать эти два состояния (преобладание необратимого компонента над обратимым) можно только с помощью динамического наблюдения за больным. Затрудняет диагностику патология верхних дыхательных путей (абсцессы глотки, эпиглоттит, аденоиды, дисфункция голосовых связок и др.) [8,15].
Причины отсутствия контроля над симптомами БА в достаточной степени условно разделены на экзогенные и эндогенные. Экзогенные (внешние) причины доминируют в структуре неконтролируемой БА. Необходимо учитывать, что в реальности эти два вида причин достаточно часто дополняют друг друга. К экзогенным причинам следует отнести неадекватную базисную терапию, связанную с недостаточной квалификацией врача или недооценкой тяжести состояния больного из-за отсутствия мониторирования клинико-функциональных показателей либо неправильным представлением пациента о своих возможностях в плане достижения наилучшего контроля над течением астмы, а также с перманентным воздействием триггеров. Экзогенной причиной можно также считать низкую комплаентность (согласие и желание пациента выполнять указания доктора, касающиеся лечения) [22].
Особого интереса заслуживают эндогенные факторы неконтролируемости БА. К доказанным в настоящее время эндогенным механизмам отсутствия контроля над симптомами болезни относят наличие сниженной чувствительности к КС (как промежуточный этап вторичной КС-резистентности) и собственно КС-резистентность I и II степени, генетически детерминированные индивидуально высокие темпы развития воспаления, неуправляемую бронхиальную гиперреактивность. В настоящее время КС-резистентность делится на два типа: первичная резистентность (тип II), обусловленная генетическим дефектом (мутация последовательности, кодирующей гормон-связывающий домен кортикостероидного рецептора) и вторичная (тип I), приобретенная в процессе лечения и в большинстве случаев обратимая [7]. Первичная КС-резистентность имеет место у 1:10 000 астматиков. Ее отличительной чертой является отсутствие побочных эффектов и изменений уровня утреннего кортизола на фоне высоких доз системных стероидов. Вышеуказанные причины представляют собой далеко не полный перечень эндогенных факторов неконтролируемости БА.
Подходы к ведению больных с неконтролируемой БА
Предпосылки к пересмотру базисной терапии БА
В связи с тем что исследование AIRE продемонстрировало отсутствие контроля над течением БА у 70% пациентов, усилия специалистов всего мира были направлены на поиск оптимальной базисной терапии данного заболевания [5, 12]. Прежде всего, оценивались эффективность и безопасность доминирующих средств базисной терапии БА — ингаляционных кортикостероидов. В процессе этих исследований были открыты феномены «плато» и «кривой безопасности» [3, 6]. Эффект «плато» означает, что при использовании ИКС в дозах, превышающих пороговые, отсутствует дальнейшее улучшение клинико-функциональных показателей у больных БА. Для взрослых такая «пороговая» доза — 800 мкг в сутки по беклометазону (400 мкг в сутки по флютиказону). Была доказана также безопасность использования указанных доз ИКС [26, 29].
Следующим шагом явился поиск наиболее эффективного фармакотерапевтического режима. В настоящее время многочисленные клинические исследования показали неоспоримое преимущество подхода step-down (старт терапии с более высокой ступени, чем того требует в настоящий момент тяжесть заболевания) для максимально быстрого подавления воспаления при БА [5, 18]. Это утверждение явно противоречит бытовавшему ранее подходу, когда нецелесообразность применения высоких доз ИКС из соображений эффективности и безопасности считалась доказанной.
Выход был найден благодаря открытию эффекта синергизма противовоспалительного действия ряда препаратов, применяющихся в комбинации с ИКС в качестве базисной. Более высокая эффективность комбинированной терапии сальметерол + ИКС по сравнению с повышением дозы ИКС у пациентов с неконтролируемой БА показана во многих исследованиях и выявлена благодаря недавно проведенному метаанализу [12, 18, 24, 28]. Добавление сальметерола к низким или высоким дозам беклометазона или флютиказона пропионата (ФП) неизменно оканчивается более эффективным в плане улучшения функции легких по сравнению с двукратным и большим увеличением дозы ИКС. Дополнительное введение в терапию пролонгированных теофиллинов или антилейкотриеновых препаратов по степени эффективности также сопоставимо с использованием двойной по сравнению с исходной дозы ИКС [30]. В отличие от комбинации ИКС с кромонами, а также препаратами теофиллина или антилейкотриеновыми лекарственными средствами совместное применение ИКС и длительнодействующих b2-агонистов можно охарактеризовать как потенцированный синергизм. Эти исследования легли в основу концепции комбинированной терапии. Согласно этой концепции, пролонгированные b2-агонисты, обладающие аддитивным эффектом, имеют преимущества перед использованием удвоенной дозы ИКС при отсутствии контроля над симптомами БА при низких и средних дозах ИКС [17].
Кроме того, неоспоримым преимуществом комбинированной терапии является одновременное воздействие на два звена патогенеза БА: воспаление (ИКС) и гиперреактивность бронхов (пролонгированные b2-агонисты) [12]. Первым препаратом комбинированной терапии, сочетающим ФП и сальметерол в одном ингаляторе, является серетид мультидиск (GlaxoSmithKline). Серетид мультидиск полностью удовлетворяет потребность в комбинированной базисной терапии, упрощает терапевтический режим, способствует плодотворному сотрудничеству врача и пациента, предоставляет возможность для гибкого подбора доз. Данный препарат был высоко оценен в ходе нескольких мультицентровых исследований и продемонстрировал высокую эффективность по сравнению с альтернативной терапией, а также ряд преимуществ перед подходом, предусматривающим использование ФП и сальметерола в разных ингаляторах (возможность применения низких и средних доз ИКС при подходе step-down) [11, 20, 21, 25].
Клинические рекомендации по применению комбинированной терапии у пациентов с неконтролируемой БА
Общая тенденция — широкое использование комбинированной терапии у пациентов с неконтролируемым течением заболевания.
Выделяют следующие этапы терапии БА [23]:
* достижение ремиссии;
* снижение объема терапии (переход на менее агрессивную терапию);
* поддержание ремиссии.
Выделение указанных этапов продиктовано особенностями патогенеза БА. Стратегически значимым является правильная формулировка целей первого этапа, а именно максимальное подавление воспаления как ведущего патогенетического механизма при данном заболевании. На схеме представлен алгоритм ведения пациентов с неконтролируемой БА.
Программа лечения определяется на основании предварительного мониторирования клинико-функциональных показателей, проводимого в течение месяца на фоне обычной терапии. Данное исследование проводится в целях стандартной оценки степени контроля над симптомами астмы (при отсутствии обострения БА).
Доза ИКС для стартовой терапии подбирается методом титрования в зависимости от степени тяжести БА (на схеме отражен средний объем терапии на первом этапе — 500 мкг в сутки по ФП). Продолжительность первого этапа терапии БА, согласно различным источникам, составляет от 1 до 6 месяцев [1, 17]. Исследования, проведенные у пациентов со среднетяжелой неконтролируемой БА, показали, что достижение оптимального контроля над течением болезни возможно у большинства пациентов (81%) по окончании 12-недельного курса стандартной базисной терапии (подход step-down для среднетяжелой БА), что совпадает со сроками редукции маркеров воспаления [1].
Цель второго этапа терапии — снижение дозы ИКС до минимально эффективной, обеспечивающей контроль над симптомами болезни. Объем терапии ИКС корригируется индивидуально под контролем показателей пиковой скорости выдоха (ПСВі80% должного). Продолжительность второго этапа — 3–6 месяцев [23].
В дальнейшем совместные усилия врача и пациента должны быть направлены на поддержание ремиссии БА (третий этап). На этом этапе возможен переход на монотерапию ИКС.
Отсутствие контроля над симптомами болезни по окончании 12-недельного курса стартовой терапии является показанием к пересмотру объема лечения. Как поступить в данной ситуации? В первую очередь необходимо иметь в виду, что у большинства пациентов на фоне стартовой терапии БА обычно отмечается редукция клинико-функциональных показателей. Так как успехи терапии, как правило, переоцениваются врачами и пациентами, у многих больных контроль над симптомами может оставаться на субоптимальном уровне. Для оценки реальной ситуации может оказаться полезным использование критериев E. Bateman на каждом этапе лечения.
Согласно рекомендациям Европейского респираторного общества по сложной астме, при отсутствии контроля над астмой на фоне стартовой терапии дозы препаратов должны быть корригированы в сторону увеличения — 2000 мкг в сутки по беклометазону сроком не менее 6 месяцев, что для ФП составит 1000 мкг в сутки [15]. Такая продолжительность применения высоких доз противовоспалительных препаратов у пациентов, у которых не удалось достичь контроля на первом этапе, продиктована необходимостью преодоления одной из наиболее частых эндогенных причин отсутствия контроля — сниженной чувствительности к КС, сформировавшейся из-за неправильного ведения пациента (длительное применение неадекватных доз КС) [7, 14, 31]. На этом этапе пациенты с неконтролируемым течением заболевания обязательно должны быть направлены к специалисту, который в дальнейшем будет их вести и анализировать причины отсутствия контроля у каждого больного.
По окончании 6-месячного курса терапии пациенты, по отношению к которым достичь контроля не удалось, будут отнесены в категорию «сложная/терапевтически-резистентная астма». Эти пациенты, как уже отмечалось, являются наиболее непредсказуемыми и сложными в плане ведения. В настоящее время, когда стандартные алгоритмы ведения пациентов со сложной БА отсутствуют, развернулась дискуссия вокруг проблемы выбора базисных препаратов сроков лечения [15].
В этой связи определенный оптимизм внушают новые перспективные разработки средств антиастматической терапии [19]. Данные препараты обладают принципиально новыми, революционными механизмами действия, что открывает недоступные ранее перспективы в лечении БА. Так, успешно прошел клинические испытания новый класс антиаллергических средств — анти-IgE АТ (антитела) (omalizumab). Механизм действия препаратов этого класса заключается в подавлении активности IgE путем связывания как циркулирующих молекул IgE, так и молекул, расположенных на поверхности В-клеток. Интересно, что omalizumab рассчитан в основном на пациентов с тяжелой БА [13]. Другой пример новых подходов к терапии БА — использование моноклональных антиинтерлейкин-5 АТ, хотя в настоящее время результаты клинических исследований, посвященных оценке эффективности препаратов данной группы, достаточно противоречивы [19]. Нельзя не упомянуть принципиально новый ИКС — ciclesonide (препарат находится в стадии разработки). Особенность данного ИКС заключается в том, что он активируется только в легочной ткани, не обладая системным действием [27]. Однако пока указанные препараты относятся к группе резерва антиастматической терапии.
Таким образом, в настоящее время комбинированная терапия является не только наиболее научно обоснованным, но и доказательным с точки зрения клинической эффективности методом лечения больных с неконтролируемой БА. Внедрение комбинированной терапии открывает новые возможности для ведения пациентов с любой степенью тяжести и любым уровнем контроля БА.
Ведение пациентов с неконтролируемой астмой 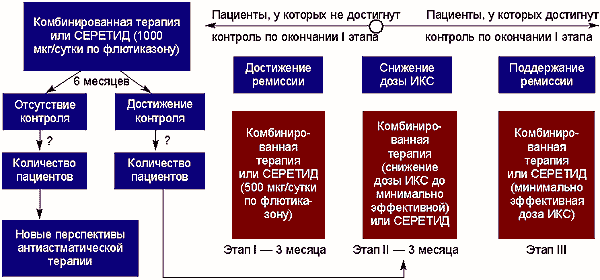
Обратите внимание!
* Термин "неконтролируемая БА" подразумевает отсутствие контроля над симптомами болезни по любым причинам.
* Во всех случаях резистентности к антиастматической терапии, а также при нетипичном течении данного заболевания следует убедиться в правильности диагноза БА.
* Причины отсутствия контроля над симптомами БА условно разделены на экзогенные и эндогенные.
* Концепция комбинированной терапии заключается в превосходстве пролонгированных b2-агонистов, обладающих аддитивным эффектом, перед использующимися в удвоенной дозе ИКС при отсутствии контроля над симптомами БА при низких и средних дозах ИКС.
* Высокая клиническая эффективность комбинированной терапии обусловлена потенцированным синергизмом ФП и сальметерола, что обеспечивает оптимальный контроль над клинико-функциональными показателями, улучшение качества жизни и снижение затрат на лечение БА.
Статья опубликована в журнале Лечащий Врач